A padronização das soluções em análises químicas
Redação
Um sistema homogêneo ou uma solução química em equilíbrio fica bem definido após o conhecimento das substâncias químicas que o constituem (análise química qualitativa), da pressão e temperatura (variáveis físicas quantitativas) e da quantidade de cada um de seus componentes (análise química quantitativa). Essas quantidades em geral são expressas em relação à quantidade de solução; outras vezes utiliza-se como referência a quantidade de um de seus constituintes que poderá então ser chamado solvente e em geral é o disperso predominante. Tais frações quantitativas são chamadas concentração. Como a concentração é um termo genérico e por si só não é uma entidade físico-química bem definida, falta para tanto caracterizá-la dimensionalmente através da escolha das grandezas representativas das quantidades das substâncias químicas em questão. Por vezes é adimensional, representando, por exemplo, a relação entre a massa de soluto e a massa da solução; outras vezes é expressa em massa por volume; ou através de inúmeras outras maneiras. A escolha dimensional obedece a critérios baseados puramente na conveniência particular ao estudo que se pretenda efetuar. E esta conveniência particular em geral se apoia no estabelecimento de equações simplificadas para expressar os princípios e leis do estudo em questão; ou então na maleabilidade operacional destas equações. Deve-se adotar as grandezas intimamente relacionadas ao número de moléculas das substâncias em estudo. Deve-se conhecer os procedimentos para a preparação, padronização e estocagem de soluções padrão volumétricas e soluções reagentes comumente usadas em análises químicas. Nesta norma são estabelecidos os procedimentos para preparação das algumas soluções.

O preparo e a diluição de soluções fazem parte da rotina de qualquer laboratório. Independente de qual seja o experimento ou análise, um dos primeiros passos será realizar a preparação de reagentes. A maioria dos laboratórios possui as soluções armazenadas em uma concentração mais alta, seja por conveniência ou para evitar a contaminação. Por isso, fazem as diluições de acordo com a demanda e necessidade para determinado experimento.
Assim, as soluções são as misturas resultantes da união de duas ou mais substâncias diferentes, que se apresentam obrigatoriamente em uma única fase no seu aspecto visual, como a água do mar (formada pela associação de água e diferentes sais). Por se tratar de misturas homogêneas, as soluções são formadas pela associação de pelo menos um material capaz de ser dissolvido por outro. Esse material dissolvido é denominado soluto, e o que dissolve é denominado solvente.
No dia a dia, dependendo da quantidade de soluto e de solvente presente na solução, costuma-se dizer que ela é fraca ou forte, indicando a sua saturação. Por exemplo, quando se prepara um suco dissolvendo o pó na água, se for colocado pouco pó pode-se dizer que o suco está fraco (diluído). Mas ao se conseguir dissolver uma quantidade muito grande de pó na água, pode-se dizer que o suco está forte (concentrado). No entanto, existem determinadas ocasiões em que a quantidade de soluto e de solvente presente na solução deve ser exata, como no caso de injeções intravenosas (como o soro fisiológico) e de soluções usadas em laboratórios e indústrias químicas.
Dessa forma, existem muitas maneiras de expressar a concentração de uma solução e por isso é tão importante a padronização de medidas. A obtenção de resultados confiáveis exige que se conheça os conceitos fundamentais, indispensáveis para qualquer procedimento analítico.
Entender e usar os termos apropriados é essencial e há vários deles usados em associação com soluções. A solução química é a mistura homogênea formada por dois componentes, o soluto e o solvente; o soluto é a substância que se dissolve em uma solução; o solvente é a substância na qual o soluto será dissolvido para formação de um novo produto; a diluição é a adição de solvente em uma solução, que diminui a concentração do soluto; a concentração é utilizada para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução; e a solução estoque é aquela concentrada que pode ser armazenada e diluída conforme necessário, fornecendo soluções de menor concentração.
Por exemplo, ao adicionar uma colher de sal em um copo com água, o sal é o soluto e a água é o solvente. A mistura desses dois componentes forma a solução. A solução diluída terá menor quantidade de sal, enquanto a solução concentrada terá uma quantidade relativamente maior. O método para medir o soluto e o solvente depende da unidade de concentração desejada.
A NBR 11589 (NB1244) de 04/2017 - Preparação, padronização e estocagem de soluções para análises químicas estabelece os procedimentos para a preparação, padronização e estocagem de soluções padrão volumétricas e soluções reagentes comumente usadas em análises químicas. Nesta norma são estabelecidos os procedimentos para preparação das seguintes soluções: solução de hidróxido de sódio 0,02 M a 1,0 M; solução de ácido clorídrico 0,02 M a 1,0 M; solução de ácido sulfúrico 0,02 M a 1,0 M; solução de nitrato de prata 0,1 M; solução de tiocianato de amônio 0,01 M; solução de iodo 0,1 M; solução de tiossulfato de sódio 0,1 M; solução de permanganato de potássio 0,1 M; solução de dicromato de potássio 0,1 M; solução metanólica de hidróxido de sódio 0,1 M; solução de sulfato cérico 0,1 M; solução de ácido perclórico em meio acético 0,1 M; solução de EDTA 0,05 M; soluções-padrão de íons; e soluções reagentes não padronizadas.
Pode-se definir uma solução-padrão como a solução de concentração determinada com exatidão, usada em análise quantitativa de produtos químicos e outros produtos. A concentração de tais soluções é expressa em termo de molaridade (mol/L). Este método envolve o uso de regentes e procedimentos que apresentam perigos à saúde e/ou risco de acidentes. É da responsabilidade de o usuário estabelecer as condições práticas para sua segurança no manuseio dos reagentes e na execução dos procedimentos. Informações adicionais sobre reagentes são dadas na ASTM E50.
Os reagentes para solução reagente podem ser obtidos no comércio e devem estar de acordo com as especificações ACS. Os reagentes para padronização de soluções padrão volumétricas devem ser produzidos por fornecedor acreditado pelo ISO Guide 34. A menos que haja outra indicação, a água deve ser a água reagente tipo III, conforme ASTM D1193-06.
Quando for indicado o uso de água destilada livre de gás carbônico, prepará-la, deixando-a em ebulição em um frasco Erlenmeyer por 20 min e transferindo-a para um frasco com tampa de borracha contendo cal sodada. Para maiores volumes (10 L a 20 L), o gás carbônico pode ser removido pelo borbulhamento de nitrogênio, através de um tubo de vidro sinterizado para dispersão de gases, introduzido até o fundo do recipiente.
São dadas diretrizes para a preparação de soluções-padrão volumétricas de concentrações mais comumente usadas. Soluções mais fracas ou mais fortes são preparadas e padronizadas da mesma maneira geral descrita, usando quantidades proporcionais dos reagentes. Se for necessário preparar quantidades maiores do que 1 L, usar quantidades proporcionais dos reagentes.
As concentrações de ácidos diluídos e de hidróxido de amônio, exceto quando padronizadas, devem ser especificadas como uma relação expressando as partes do volume do reagente concentrado a ser diluído com as partes de um dado volume de água, como, por exemplo, HCI (5+95) significa cinco partes de HCI concentrado (densidade 1,19), diluídas com 95 partes de água. Quando forem preparados volumes de soluções maiores do que 1 L ou 2 L, são encontrados problemas para a sua homogeneização, antes da padronização. Agitadores de lâmina com hastes de vidro ou de metal não são indicados para todos os casos.
Nos casos em que o contato de um agitador de vidro ou de metal com solução não é desejado, é possível usar um agitador recoberto com filme de poliolefina. Quando precisar ser evitado somente o contato da solução com o metal, homogeneizar através do borbulhamento de nitrogênio, através de um tubo de vidro sinterizado, colocado no fundo do recipiente, durante 1 h ou 2 h. Recipientes de vidro são apropriados para a estocagem da maioria das soluções-padrão, embora o uso de recipientes de poliolefina seja recomendado para soluções de álcalis.
Quando grandes quantidades de soluções são preparadas e padronizadas, é necessário providenciar proteção contra mudanças na molaridade, devidas à absorção de gases ou vapor d’água do ar do laboratório. À medida que a solução vai sendo consumida, o suprimento de ar deve passar através de um tubo de secagem cheio com partes iguais de cal sodada de 8 mesh a 20 mesh, ácido oxálico e cloreto de cálcio anidro de 4 mesh a 8 mesh, sendo cada produto separado do outro por um batoque de lã de vidro de fibra longa.
Os métodos de padronização são dados para cada solução volumétrica, embora os métodos de preparação para algumas destas soluções especifiquem que sejam conduzidos sob determinadas condições. Como não é possível preparar grandes volumes de soluções com precisão, é fornecido um método de padronização para estas soluções. Quanto à aparelhagem, o uso de vidraria volumétrica comum deve atender às exigências de precisão de muitos métodos de ensaio.
Para os ensaios dependentes de exatidão, a vidraria volumétrica deve estar de acordo com os requisitos para, Classe A, constantes na ASTM E694-99. Para trabalhos usuais, a vidraria que atenda a estas especificações pode ser usada sem as correções de calibração. É preferível que as correções de calibração sejam usadas nas padronizações de soluções volumétricas.
Tais correções podem ser de significância, quando o material volumétrico é frequentemente utilizado com soluções alcalinas, pois o efeito corrosivo do álcali sobre o vidro pode resultar em mudanças do volume aparente. É recomendado, portanto, que seja verificada a calibração da vidraria volumétrica, particularmente buretas e pipetas de transferência a intervalos de três meses, quando usada com frequência, na medida de volumes de solução de álcali.
Pode ser utilizada bureta de vidro automática ou tituladores automáticos. É recomendado que seja calibrada periodicamente, considerando a frequência de utilização e os reagentes utilizados. Para uso com soluções alcalinas, são preferíveis as buretas equipadas com torneiras de politetrafluoretileno (PTFE). Soluções volumétricas são frequentemente usadas em temperaturas diferentes daquela na qual foram preparadas. Erros significantes podem ser introduzidos quando as soluções são usadas nestas outras temperaturas.
Os valores para mudança da normalidade devido à temperatura (?M/°C) foram estabelecidos para as soluções volumétricas aqui descritas e estão listadas na tabela abaixo. Quando forem desejadas garantias de precisão do trabalho, as normalidades das soluções podem ser corrigidas para a temperatura na qual elas são usadas, como a seguir: Mt = Mt1 + (t1 - t2) F, onde, Mt é a molaridade da solução, expressa em mol por litro (mol/L) por ocasião da padronização; Mt1 é a molaridade da solução, expressa em mol por litro (mol/L) por ocasião do uso; t1 é a temperatura da solução, expressa em graus Celsius (°C) durante a padronização; t2 é a temperatura da solução, expressa em graus Celsius (°C) durante o uso; e F é o fator para corrigir a expansão térmica da solução (?M/°C obtido na tabela abaixo).
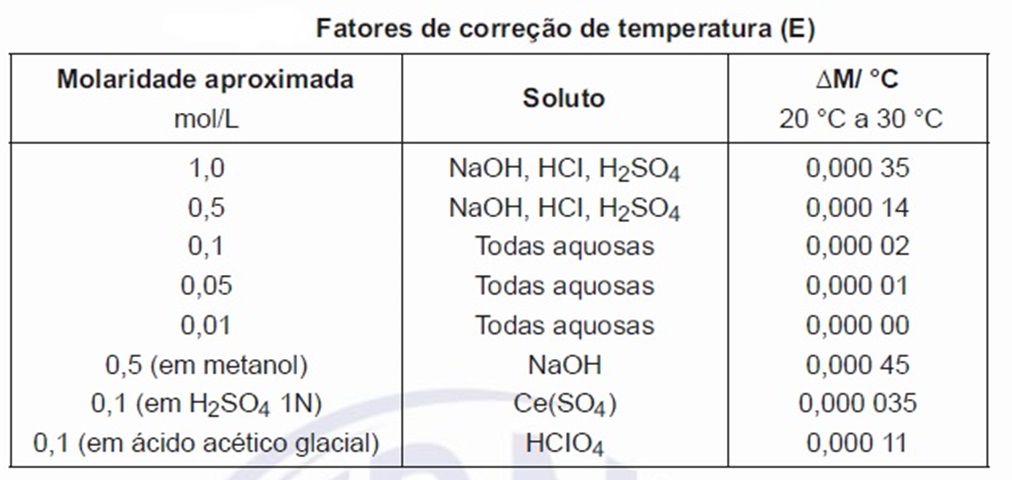
Na fórmula, pode-se deduzir que a correção deve ser adicionada à molaridade da solução, quando padronizada, se a temperatura de uso for mais alta do que a temperatura de padronização. Quando se requer que uma substância química seja pesada com exatidão, a pesagem deve ser efetuada de modo que o limite de erro seja de 0,1% ou menos.
Quando uma massa especificada da substância for indicada em um procedimento, a menos que haja outra especificação no procedimento individual, significa que deve ser uma quantidade aproximada de 5 % da massa indicada, e que esta quantidade deve ser “pesada com exatidão”, conforme definido nesta norma. Na pesagem de padrões primários a serem usados na padronização de soluções volumétricas, muitos laboratórios usam pesar o mais próximo possível de 0,1 mg, mesmo que tal aumento de exatidão da pesagem não melhore a exatidão ou a precisão da padronização.
Quando são especificadas as leituras em bureta, ou quando o procedimento pressupõe que um volume específico seja medido de uma bureta, a leitura deve ser estimada na metade da menor subdivisão de volume marcada na bureta. Portanto, na leitura de uma bureta de 50 mL, com subdivisão de 0,1 mL, a leitura deve ser estimada com aproximação de 0,05 mL. Para a expressão dos resultados, é comum expressar a normalidade e a molaridade de soluções-padrão a uma parte por mil (com três casas decimais).
Com relação ao estado físico de agregação em que se encontram, pode-se classificar as soluções em: sólidas, como o ouro 18 quilates, latão e outras ligas metálicas diversas; as líquidas, como o soro fisiológico, álcool comercial e água com açúcar; as gasosas, como o ar atmosférico entre outras misturas gasosas de interesse comercial. Em casos onde todos os componentes da solução se encontram no mesmo estado físico, considera-se o soluto o composto presente em menor quantidade, e solvente o composto presente em maior quantidade na mistura.
Com relação à natureza do soluto, pode-se classificar as soluções em: iônicas que são compostas de solutos iônicos, por exemplo, NaCl em água; moleculares que são compostas por solutos de origem molecular, por exemplo, água com açúcar (C12H22O11 + H2O). Há casos especiais onde há presença de compostos iônicos e moleculares compondo a solução, como o caso do ácido acético em água que possui moléculas CH3COOH e íons CH3COO- e H+.
Com relação entre a quantidade de soluto e solvente que compõe a solução denominada saturação da solução, pode-se classificá-las em: insaturadas que possuem menor quantidade de soluto em relação à quantidade de solvente; saturadas que possuem a máxima quantidade de soluto em determinada quantidade de solvente; as supersaturadas que possuem maior quantidade de soluto em relação à quantidade de solvente. As soluções podem ser concentradas ou diluídas, de acordo com a necessidade e aplicação a qual se destinam.
Nas soluções concentradas, o volume total de solução diminui, porém, a concentração de soluto se mantém a mesma, já nas soluções diluídas, o volume total é aumentado, contudo a concentração de soluto se mantém a mesma. Para realizar as diluições ou aumentar a concentração de soluções, utiliza-se a seguinte fórmula: C(inicial) x V(l) (inicial) = C(final) x V(l) (final), onde: C = concentração (inicial e final, respectivamente); V = volume de solução em litros (inicial e final, respectivamente). As diferentes relações entre a quantidade de soluto, de solvente e de solução são denominadas genericamente de concentrações. A concentração comum (C) é também chamada concentração em g/L (grama por litro), relaciona a massa do soluto em gramas com o volume da solução em litros.

Hayrton Rodrigues do Prado Filho



















