A conformidade das seringas para uso humano
Redação
As seringas são utilizadas para o preparo e administração de um medicamento e seus componentes incluem o êmbolo que é a parte interna da seringa, usada para puxar e empurrar o medicamento; o corpo que é parte externa da seringa, local em que a medicação é introduzida; e o bico que é parte distal da seringa, onde se encaixa a agulha. Assim, é um produto médico, de uso único, não-invasivo, destinado à condução, administração ou introdução no corpo de medicamentos utilizados para a profilaxia, tratamento ou diagnóstico. As agulhas são produtos médicos, de uso único, que penetram total ou parcialmente dentro do corpo humano através da superfície corporal, podendo ser utilizada por diversas vias, e ainda para realização de biópsia, tratamento de canal, entre outros. Ambos os produtos são amplamente utilizados nas unidades de assistência médica, odontológica e hospitalar, tanto no sistema público, quanto privado. Estima-se que mais de 1.000.000 de injeções sejam administradas anualmente no mundo, e a ocorrência de desvios e qualidade nestes produtos podem comprometer um grande número de pessoas, causando um grande impacto na saúde pública. O cumprimento das normas técnicas é obrigatório para esses produtos.
Hayrton Rodrigues do Prado Filho –
As seringas de duas peças compreendem o cilindro e o pistão, sendo que a haste e o êmbolo formam um componente feito do mesmo material e as de três peças compreendem o cilindro e o pistão, sendo que a haste e o êmbolo são dois componentes separados de materiais diferentes. Segundo o Grupo SOL-Millennium, o equipamento é utilizado para inserir substâncias líquidas por via intravenosa (aplicação na veia), hipodérmica (aplicação na pele), intrarraqueana ou intrarraquidiana (anestesia), intramuscular (aplicação no tecido muscular), intracardíaca (aplicação na parede cardíaca), assim como para retirar sangue e para a realização de punção aspirativa em um paciente.
O físico, matemático, filósofo moralista e teólogo francês Blaise Pascal, em 1647, se interessou pela hidrostática e realizou várias experiências que comprovaram a existência do vácuo e o peso do ar. Apesar do alvo ter sido puramente técnico, nesse mesmo ano ele inventou a seringa como subproduto de suas pesquisas. O primeiro indivíduo que utilizou o instrumento por via intravenosa, ou seja, na veia, foi Christopher Wren, na Grã-Bretanha. Em 1656, foi apresentada a documentação na qual dizia que Pascal estava conduzindo experimentos em cães, injetando-os com ópio e outras substâncias.
O tipo de seringa que ele usou é conhecido por seu dispositivo muito rudimentar, constituído por uma caneta de pena que foi anexada à bexiga de um animal pequeno. Logo após a aplicação do dispositivo na pele, uma incisão teve que ser feita para tornar a veia acessível. Houve também o experimento em um ser humano, cuja descrição em um relatório diz que o sujeito da experiência era o servo delinquente de um embaixador estrangeiro, e há indícios no documento de que a experiência não foi bem-sucedida.
Já em 1853, o escocês Alexander Wood, nascido em Cupar of Fife (Escócia), professor da Faculdade de Medicina de Edimburgo, criou a agulha oca. Segundo ele, a principal virtude de seu invento, que já possuía um sistema injetor, era permitir depósitos de morfina em íntimo contato com nervos envolvidos em processos dolorosos. No mesmo ano, a seringa foi inventada pelo ortopedista francês Charles Gabriel Pravaz, nascido em Pont de Beauvoisin, para desenvolvimento de estudos e para injeção de remédios.
As seringas e agulhas são materiais de consumo para a área de saúde, sendo adquiridos em grandes quantidades – muitas vezes através de licitações públicas. Há uma acirrada disputa dos diferentes fabricantes, sejam eles nacionais ou importados, e um grande número de notificações à Anvisa sobre diversos problemas apresentados por esses produtos, quanto à sua qualidade no que diz respeito ao risco de danos tanto para o paciente como para o técnico de saúde que os manipula.
Os riscos associados ao uso de seringas e agulhas que não atendam aos parâmetros definidos nas normas técnicas são os mais diversos, dependendo do tipo de não conformidade. Como exemplo, se o rótulo não apresentar o número do registro do produto na Anvisa, ou os dados do fabricante ou importador, ao ocorrer um acidente de consumo o paciente pode encontrar dificuldades para requerer qualquer ação da Anvisa sobre o problema. Ausência de informações pode indicar também que o produto é falsificado.
Se a embalagem não possuir resistência suficiente para manter-se íntegra ou se permitir facilmente a abertura pelo lado errado, não garantirá a manutenção da esterilidade do produto antes nem durante seu uso. Se o produto não for fabricado sob condições tais que garantam sua esterilidade tanto microbiológica quanto química, ou seja, que garantam a ausência de contaminantes, pode ocorrer o desenvolvimento de danos, de afecções, de intoxicações ou até mesmo de doenças mais graves no paciente que utilizar tais produtos.
Se a agulha, quando conectada, não se apresentar alinhada ao eixo da seringa, poderá prejudicar a precisão da perfuração da agulha no corpo, levando a um maior dano ou trauma ao paciente. Outra possível causa de danos ou mesmo de desconforto ao paciente é a presença de irregularidades na ponta da agulha, a qual deve garantir uma penetração fácil e sem traumas. Se a agulha não possuir a devida resistência à corrosão na cânula (tubinho de aço da agulha), poderá enferrujar (oxidar) em algum momento, até mesmo durante o processo de esterilização do produto. Isso pode causar reações alérgicas ou tóxicas, o que pode ser agravado em pacientes que necessitam fazer uso diário desse produto durante um tratamento médico.
Outro problema que se pode associar à não resistência à corrosão é a fragilização da agulha, que pode quebrar durante sua utilização. As informações do rótulo, bem como as exigências para a embalagem e para todo o processo de fabricação das seringas e das agulhas, são fundamentais para se estabelecer a segurança do produto. Conforme exemplificado, são inúmeras as exigências que devem ser atendidas, pois são muitos os riscos à saúde e segurança do consumidor que devem ser evitados.
Dessa forma, se um produto é fabricado respeitando-se todas essas exigências e compartilha o mercado com outro que não atende, cria-se um ambiente de concorrência desleal, especialmente porque existem investimentos que são necessários (e indispensáveis), que afetam o preço final desses produtos. A NBR ISO 7886-1 de 01/2020 - Seringa hipodérmica estéril de uso único - Parte 1: Seringa para uso manual especifica os requisitos e os métodos de ensaio para verificar o projeto de seringas hipodérmicas estéreis vazias de uso único, com ou sem agulha, feitas de plástico ou outros materiais, e destinadas à aspiração e injeção de fluidos, após serem preenchidas pelos usuários finais.
Este documento não fornece requisitos para liberação de lote. As seringas são para uso principalmente em humanos. As seringas estéreis especificadas neste documento são destinadas ao uso imediatamente após serem preenchidas e não são destinadas a conter o medicamento por períodos de tempo prolongados.
Este documento exclui as seringas para uso com insulina (ver ISO 8537), seringas de uso único feitas de vidro, seringas para uso com bombas acionadas por energia, seringas previamente preenchidas pelo fabricante e seringas destinadas a serem armazenadas após serem preenchidas (por exemplo, em um conjunto para ser preenchido por um farmacêutico). As seringas hipodérmicas sem uma agulha especificada neste documento são destinadas ao uso com agulhas hipodérmicas especificadas na ISO 7864.
A série ISO 7886 cobre seringas hipodérmicas destinadas principalmente ao uso humano e fornece requisitos de desempenho e de ensaio. Ela permite uma variedade mais ampla de projetos, de modo a não limitar a inovação e os métodos de embalagem. Sua aparência e formatação são consistentes com outras normas relacionadas, as quais são projetadas para serem mais baseadas no desempenho do que prescritivas do projeto.
Os requisitos gerais, como diretrizes de projeto para fabricantes, são introduzidos neste documento. Diversos limites para requisitos que são baseados em histórico, mas confirmados na prática por muitos anos, foram mantidos. Os materiais a serem usados para a construção e lubrificação de seringas estéreis de uso único não são especificados, uma vez que sua seleção dependerá, até certo ponto, do projeto, do processo de fabricação e do método de esterilização empregado por fabricantes individuais.
Convém que os materiais da seringa sejam compatíveis com fluidos injetáveis. Se este não for o caso, convém que seja chamada atenção do usuário para a exceção na rotulagem da embalagem unitária. É impraticável especificar um método de ensaio de incompatibilidade universalmente aceitável, pois o único ensaio conclusivo é aquele no qual um fluido injetável específico é compatível com uma seringa específica.
A indústria farmacêutica usa solventes em preparações injetáveis. Convém que tais solventes sejam submetidos a ensaio pelo fabricante da preparação injetável para qualquer incompatibilidade possível com os materiais frequentemente usados na construção de seringas. Caso uma incompatibilidade seja identificada, convém que o fluido injetável seja adequadamente rotulado.
A impossibilidade de ensaiar qualquer fluido injetável com todas as seringas disponíveis é reconhecida e é fortemente recomendado que as autoridades reguladoras e associações de comércio relevantes reconheçam o problema e tomem medidas apropriadas para dar assistência aos fabricantes de preparações injetáveis. Convém que seringas sejam fabricadas e esterilizadas de acordo com códigos nacionais ou internacionais reconhecidos de boas práticas de fabricação de produtos para saúde.
Os planos de amostragem para inspeção selecionados para a série ISO 7886 têm o objetivo de verificar o projeto em um alto nível de confiança. Os planos de amostragem para inspeção não substituem os requisitos gerais de sistemas da qualidade de fabricação que aparecem em normas sobre sistemas da qualidade, por exemplo, a série ISO 9000 e a NBR ISO 13485.
Espera-se que os fabricantes sigam uma abordagem baseada no risco e empreguem engenharia de usabilidade durante o projeto, desenvolvimento e fabricação de seringas. Orientações sobre períodos de transição para implementar os requisitos da ISO 7886 (todas as partes) são dadas no ISO/TR 19244. A nomenclatura para os componentes de seringas hipodérmicas de uso único é apresentada na figura abaixo.
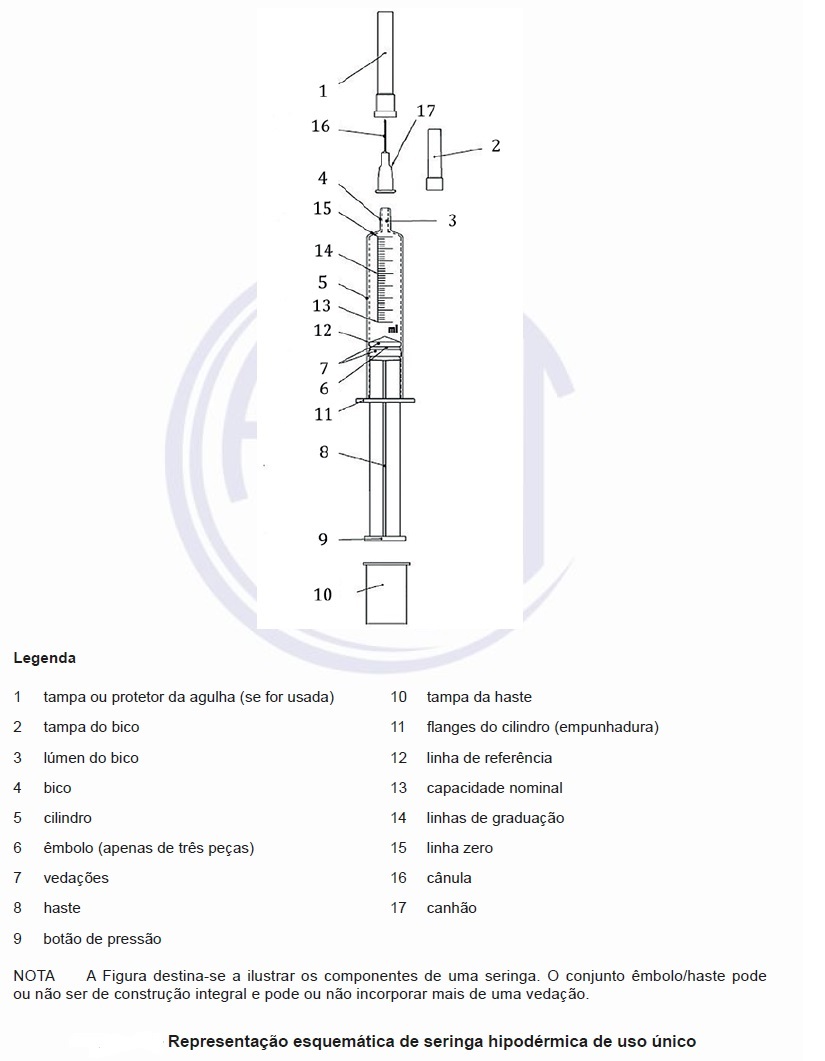
Os requisitos gerais são considerados entradas de projeto para os fabricantes. As seringas devem ser isentas de defeitos que afetem a aparência, a segurança e o desempenho para seu uso pretendido. Seringas com proteção integrada ou acoplável contra perfurocortantes devem estar em conformidade com a ISO 23908. Os flanges do cilindro da seringa devem ser de tamanho, formato e resistência adequados ao propósito pretendido.
As especificações de projeto para os flanges do cilindro devem ser determinadas por meio de análise de risco e confirmadas por meio de ensaios de validação de usabilidade. Os materiais das seringas não podem liberar, sob condições de uso normal, quantidades significativas de substâncias tóxicas, e devem permitir que elas satisfaçam os requisitos ou regulações nacionais apropriadas para isenção de materiais pirogênicos e toxicidade anormal.
Os materiais usados na construção da parede do cilindro da seringa devem ter transparência suficiente para permitir que as dosagens sejam lidas sem dificuldade. A norma não especifica os materiais a serem usados para a construção e lubrificação de seringas estéreis com ou sem agulhas de uso único, porque sua seleção dependerá, até certo ponto, do projeto, do processo de fabricação e do método de esterilização da seringa específicos dos fabricantes.
O projeto e a validação da embalagem devem levar em consideração o uso final da seringa, as condições de armazenamento e transporte, além do prazo de validade estabelecido. As superfícies da seringa que entram em contato com os fluidos injetáveis durante o uso normal devem estar livres de partículas e matéria estranha. A conformidade com este requisito será determinada por meio de inspeção realizada por um indivíduo com visão normal (ou visão corrigida para o normal), sem ampliação.
A exposição de água destilada à seringa como produto final não pode alterar seu valor de pH em mais do que uma unidade. A conformidade com este requisito deve ser demonstrada preparando-se as soluções descritas no Anexo A. Os resultados devem mostrar que o valor de pH do fluido de avaliação da seringa está dentro de uma unidade de pH do valor de pH do fluido de controle.
O valor do pH de ambas as soluções pode ser determinado com um medidor de pH potenciométrico laboratorial usando um eletrodo de uso geral. Mais do que um total combinado de 5 mg/kg de chumbo, estanho, zinco e ferro; o teor de cádmio deve ser menor que 0,1 mg/kg. A conformidade com este requisito deve ser demonstrada preparando-se as soluções descritas no Anexo A e submetendo-as a ensaio usando um método microanalítico reconhecido, por exemplo, por um método de absorção atômica ou por um método de espectrometria de massa de plasma acoplada indutivamente (ICP).
Quando o êmbolo estiver completamente inserido, a quantidade de lubrificante aplicada no cilindro não pode atingir o canal Luer do bico. Para lubrificantes aplicados à superfície interna da seringa, a quantidade de lubrificante aplicada não pode exceder 0,25 mg/cm² da área de superfície interna da seringa em contato com o fluido injetável. Convém que a quantidade e a distribuição de lubrificante aplicado sejam otimizadas para minimizar a visibilidade do lubrificante.
Um lubrificante aceitável é o silicone em conformidade com uma farmacopeia nacional ou europeia e com a ISO 10993-1. Para lubrificantes incorporados na formulação do polímero, a quantidade de lubrificante não pode exceder 0,6% (m/m) da massa do componente, mas chama-se a atenção para o fato de que algumas regulações nacionais podem especificar uma concentração máxima mais baixa.
Se um lubrificante for incorporado na formulação do polímero, as partículas visíveis podem se tornar aparentes, quando o lubrificante aflora à superfície do cilindro da seringa e o êmbolo o remove. Exemplos de lubrificantes aceitáveis incorporados na formulação do polímero são as amidas de ácidos graxos de ácido erúcico e/ou oleico em conformidade com a ISO 10993-1. Ver o Anexo F para um método de ensaio para a quantidade de óleo de silicone. As tolerâncias na capacidade graduada devem ser conforme apresentado na tabela abaixo.
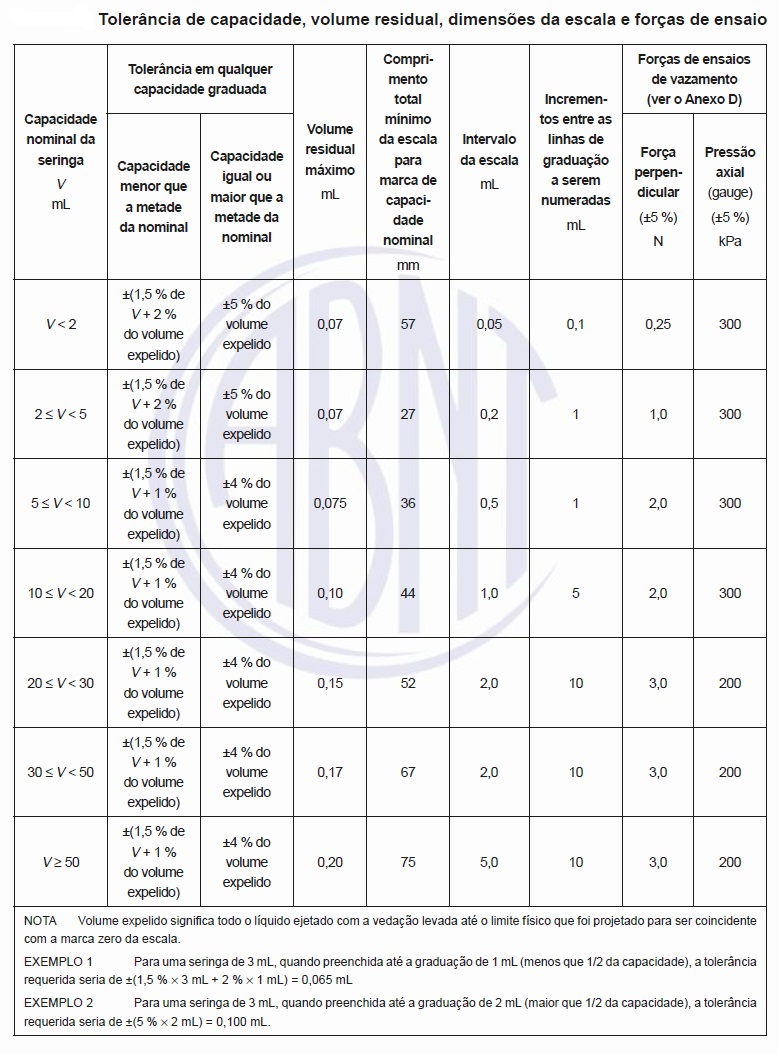
A seringa deve ter uma ou mais escalas, desde que sejam idênticas, as quais devem ser graduadas e numeradas pelo menos nos intervalos dados na tabela acima. A unidade de volume deve estar marcada no cilindro. O intervalo da escala pode ser menor (mais estreito) do que o intervalo da escala dado na tabela acima. Caso seja necessária uma aplicação específica, a escala pode variar e este requisito não impede o fornecimento de marcas de graduação adicionais dentro da escala ou como extensões à escala.
Convém que qualquer variação da escala ou graduação seja avaliada quanto ao risco de acordo com a ISO 14971 e quanto à usabilidade de acordo com a IEC 62366. A capacidade graduada total pode ser igual a, ou maior que, a capacidade nominal. Se a escala estiver ampliada além da capacidade nominal, a porção ampliada deve ser diferenciada do resto da escala.
Exemplos de meios de diferenciação são os seguintes: circular o número da escala da linha de capacidade nominal; usar números de escala menores para as linhas de graduação extra; usar linhas de graduação mais curtas para as linhas de graduação extra; usar uma linha pontilhada para a linha vertical opcional do comprimento de escala extra.
As linhas de graduação devem ser de espessura uniforme. Estas devem situar-se em planos perpendiculares ao eixo do cilindro. As linhas de graduação devem estar igualmente espaçadas ao longo do eixo longitudinal entre a linha de graduação zero e a linha para a capacidade total graduada. Quando a seringa é mantida verticalmente, as extremidades de todas as linhas de graduação de comprimentos similares devem estar alinhadas verticalmente.
Convém que os comprimentos das linhas de graduação mais curtas em cada escala sejam aproximadamente metade do comprimento das linhas mais longas. Se forem usadas configurações diferentes de linhas de graduação, isto pode ser submetido a uma avaliação de usabilidade de acordo com a IEC 62366.
A NBR ISO 7886-2 de 08/2003 - Seringa hipodérmica estéril para uso único - Parte 2: Para uso em bomba de seringa especifica os requisitos para seringas estéreis de uso único, de capacidade nominal maior ou igual a 5 mL, fabricadas em material plástico e indicadas para uso em bomba de seringa. Não se aplica a seringas para uso com insulina (especificadas na ISO 8537), seringas de uso único feitas de vidro (especificadas na ISO 595), seringas previamente cheias pelo fabricante com medicamento e seringas fornecidas com medicamentos em um kit para uso por um farmacêutico. Não indica compatibilidade entre a seringa e o injetável.
Na preparação desta parte da NBR ISO 7886 reconheceu-se desde o início que o critério absoluto de desempenho é atingido através da combinação da bomba de seringa e da seringa trabalhando como um sistema completo. A dependência de um elemento do sistema no desempenho do outro é um fator-chave. É essencial que o fabricante de um desses componentes faça contato com o fabricante do outro ao considerar mudanças no projeto, de forma a assegurar a operação satisfatória do sistema.
Em particular, mediante solicitação do fabricante da bomba, o fabricante da seringa deve dar informações sobre as tolerâncias e a relação entre as dimensões da seringa especificada nesta parte da NBR ISO 7886 e sobre as características de desempenho, tais como força para mover a haste e as variações que podem ser esperadas. O uso de seringas, as quais foram inicialmente projetadas e usadas como produtos de operação manual em bombas de seringas, agora faz com que seja desejável atingir-se tolerâncias mais apertadas (justas) nas dimensões da seringa do que normalmente eram exigidas no uso manual.
Pode-se entender que o grau de investimento mundial por parte de todos os fabricantes de seringas na moldagem e fabricação de equipamentos é tal, que uma mudança como a modificação de diâmetros da base da haste ou diâmetro interno do cilindro está amplamente fora do alcance da indústria de seringas. Normalmente, a altura (hard height) da seringa nunca foi considerada uma dimensão particularmente crítica.
Suas tolerâncias são relativamente frouxas. A dimensão da altura (hard height) é uma função não apenas do comprimento total da haste e do cilindro, mas também da espessura do pistão e dos flanges. A espessura do pistão cujo processo de fabricação é relativamente simples pode variar consideravelmente.
Devido ao fato de que todos estes componentes são fabricados em moldes com multicavidades a partir de muitos moldes espalhados ao redor do mundo, a tolerância extrema cumulativa oriunda de cavidade para cavidade, de molde para molde e de local para local é tal que estas dimensões anteriormente consideradas como não críticas não podem ser instantaneamente ajustadas. Assim, é importante que quando a seringa for colocada na bomba, esta esteja corretamente programada para funcionar satisfatoriamente com a seringa instalada.
Em vista das consequências causadas pela identificação incorreta da seringa pela bomba, reconheceu-se a necessidade de um sistema automático. Métodos já em uso, tais como sensores mecânicos do diâmetro externo da seringa, ainda não são considerados viáveis no longo prazo. Isto deve-se à superposição das faixas de diâmetro das seringas produzidas por diferentes fabricantes e à falta de relação entre os diâmetro interno e externo de uma seringa.
Também se reconheceu que a padronização dos diâmetros do cilindro em toda indústria não é uma alternativa realista. Um meio pelo qual a bomba pode automaticamente identificar o modelo de seringa e usar esta informação para programar tal informação como diâmetro interno do cilindro, a força da haste e parâmetros de alarmes de oclusão será visto no próximo passo (estágio) desta parte da NBR ISO 7886.
Um método possível de reconhecimento é identificar a seringa e a capacidade nominal através de um código no cilindro, impresso no momento em que a seringa é pesada e de forma a usar este código para programar a bomba automaticamente. É recomendável que o desenvolvimento deste sistema seja feito assim que possível.
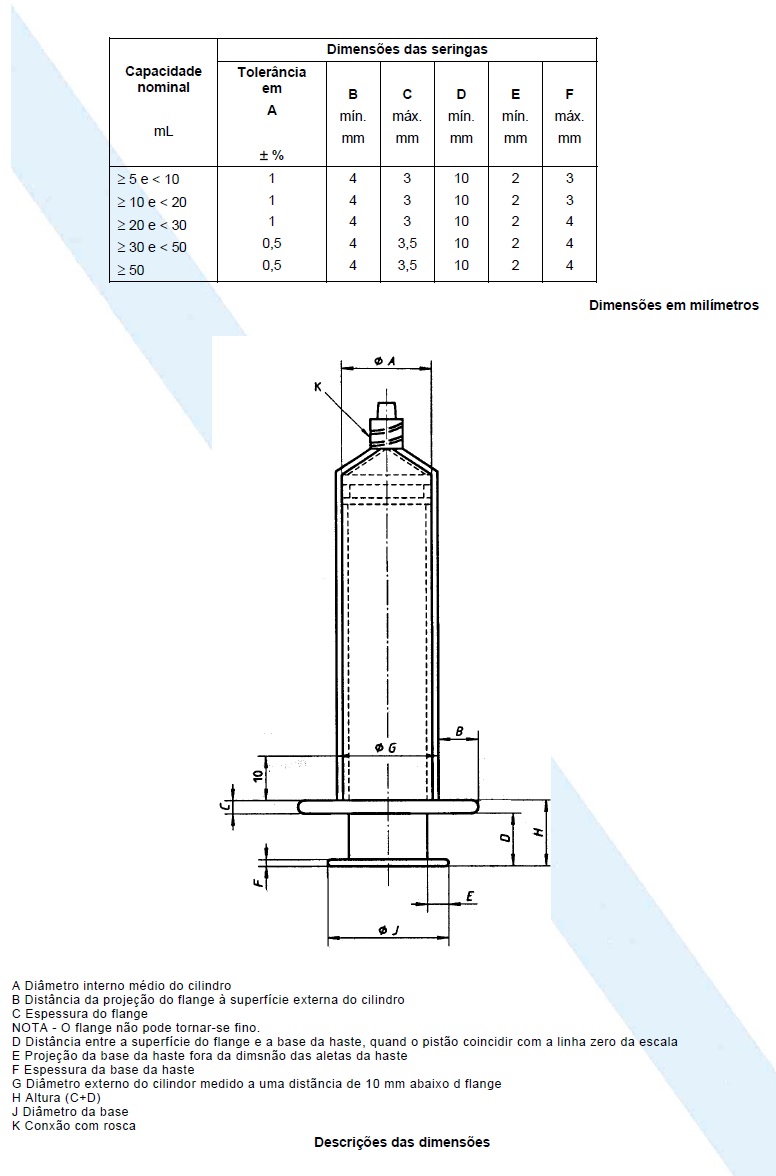
As dimensões críticas para montar a seringa em uma bomba devem ser conforme a figura abaixo e a tabela abaixo. Todas as outras dimensões e requisitos de projeto devem ser conforme a NBR ISO 7886-1. O botão de pressão deve ser tal que não impeça nem o encaixe no mecanismo de uma bomba de seringa projetado para receber uma base plana, nem a detecção por um dispositivo sensor incorporado. É recomendado que os componentes da seringa sejam projetados de maneira a dificultar a retirada completa da haste do cilindro.
Cada seringa deve ser selada em uma embalagem primária. É recomendado que os materiais da embalagem primária não tenham efeitos prejudiciais para o conteúdo e que o material e modelo dessa embalagem sejam tais que assegurem: a manutenção da esterilidade do conteúdo, sob condições de armazenamento: seco, limpo e adequadamente ventilado; o risco mínimo de contaminação durante a abertura da embalagem e extração do conteúdo; a proteção adequada dos conteúdos durante o manuseio normal, transporte e armazenagem; que uma vez aberta a embalagem primária, não possa ser facilmente vedada novamente, devendo apresentar evidências de que tenha sido aberta.
Uma ou mais embalagens primárias devem ser acondicionadas em uma embalagem secundária. É recomendado que a embalagem secundária seja resistente o suficiente, para proteger o conteúdo durante o manuseio, transporte e armazenagem. Uma ou mais embalagens secundárias podem ser acondicionadas em embalagens de armazenamento e/ou transporte.
A embalagem primária deve ser marcada conforme a NBR ISO 7886-1 e com as seguintes informações: com a frase: “Para uso em bombas de seringas”, ou equivalente; a identificação do modelo, se o fabricante oferecer mais do que um produto da mesma capacidade nominal. A embalagem secundária deve ser marcada conforme NBR ISO 7886-1 e com as informações já listadas.
Se a embalagem secundária for acondicionada em uma embalagem de armazenamento, aplica-se a subseção 16.3 da NBR ISO 7886-1:2003, além das informações listadas. O cilindro da seringa deve ser marcado com: a logomarca ou nome do fabricante; a identificação do modelo, se o fabricante oferecer mais de um produto da mesma capacidade nominal.
A NBR ISO 8537 de 12/2012 - Seringas estéreis de uso único, com ou sem agulha, para insulina especifica os requisitos e métodos de ensaios para seringas estéreis, com ou sem agulhas, indicadas somente para aplicação de insulina. As seringas são para uso único em seres humanos. Abrange seringas para uso com 40 unidades de insulina/mL (U-40) e 100 unidades de insulina/mL (U-100). As seringas estéreis especificadas nesta norma são indicadas para uso logo após o preenchimento, uma vez que não são adequadas para armazenar insulina por períodos de tempo prolongados.
Necessária no tratamento do diabetes tipo 1, o uso da insulina deve ser iniciado imediatamente após o diagnóstico. As necessidades diárias de insulina variam de acordo com a idade, rotina diária, padrão alimentar e sobretudo, a presença ou não de alguma secreção residual de insulina pelas células ß pancreáticas.
De uma maneira geral, no início do quadro a necessidade diária de uma pessoa oscila entre 0,3 a 0,6 U/kg, podendo chegar a 1U/kg no final do primeiro ano de doença. Há inúmeras preparações insulínicas, que variam de acordo com a origem e o tempo de ação. Dessa forma, os portadores de diabetes tipo 1 têm que aplicar insulina diariamente o que envolve o uso de seringa e agulha.
A norma trata, principalmente, de produtos para uso em humanos e estabelece requisitos de desempenho, mas permite algumas variações de modelos de métodos de embalagem e esterilização por fabricantes individuais. Os materiais a serem usados na construção e lubrificação de seringas e agulhas estéreis, de uso único, não estão especificados, já que sua seleção depende até certo ponto do projeto, processo de fabricação e métodos de esterilização empregados por fabricantes individuais.
Recomenda-se que as seringas e agulhas sejam fabricadas e esterilizadas de acordo com os procedimentos de boas práticas de fabricação de produtos médicos, reconhecidos nacional ou internacionalmente. Recomenda-se que sejam livres de defeitos que afetem a aparência, a eficácia, a segurança e o uso pretendido.
Certos tipos de polipropileno, poliestireno e estireno/copolímero de acrilonitrilo têm sido extensivamente usados para a fabricação dos cilindros das seringas estéreis de uso único. Uma composição de borracha natural de alta qualidade é frequentemente usada para o pistão, embora outros materiais, como a borracha de silicone, sejam também usados, sendo a superfície do pistão lubrificada com o polidimetilssiloxano.
Para a seringa de 2 mL, o polietileno de alta densidade é frequentemente usado para selar os dois componentes do corpo da seringa em combinação com o cilindro de polipropileno contendo uma amida de ácido graxo como agente deslizante. Quando forem selecionados materiais, considerar o seguinte: quanto à transparência do cilindro, é recomendado que os materiais usados na construção da parede do cilindro sejam transparentes, para possibilitar a leitura das dosagens sem dificuldade e para a visualização das bolhas de ar.
Para a compatibilidade com as preparações de insulina, é recomendado que os materiais das seringas e agulhas (incluindo lubrificante) e da embalagem, na sua forma final, depois da esterilização e sob condições de uso normal, não afetem danosamente a eficácia, segurança e aceitabilidade das preparações de insulina: recomenda-se também que os materiais de construção não sejam afetados física ou quimicamente pelas preparações de insulina.
Para a biocompatibilidade, recomenda-se que os materiais não permitam que as seringas e as agulhas produzam, sob condições de uso normais, quantidades significativas de substâncias tóxicas, e recomenda-se que permitam satisfazer os requisitos nacionais apropriados ou regulamentos de apirogenicidade e toxicidade anormais. Para ensaiar estas propriedades, pode ser usado o Anexo H disponível na norma e como especificado.
É extremamente recomendado que as autoridades regulatórias, farmacopeia e associações comerciais importantes reconheçam a necessidade de estudos mais profundos, especialmente para incompatibilidade entre as insulinas e seringas, quando em contato por período prolongado. Em alguns países, os regulamentos nacionais estão legalmente vinculados e seus requisitos podem ter precedência sobre essa norma, que descreve seringas com e sem agulhas para uso com 40 unidades de insulinal/mL (U-40) e 100 unidades de insulina/mL (U-100). É recomendado que as seringas graduadas para uma única concentração de insulina sejam usadas em cada país para evitar acidentes.
Para aqueles países que usam mais que uma concentração de insulina, é enfatizada a importância de ter seringas individuais apropriadamente graduadas para uma única concentração de insulina, como especificado nessa norma. Sérios problemas podem ser acarretados se uma seringa for usada com uma concentração de insulina para qual não foi projetada. Se a seringa for usada para misturar diferentes tipos de insulina, é extremamente recomendado que a cada vez que o procedimento for realizado seja na mesma sequência.



















